文章插图
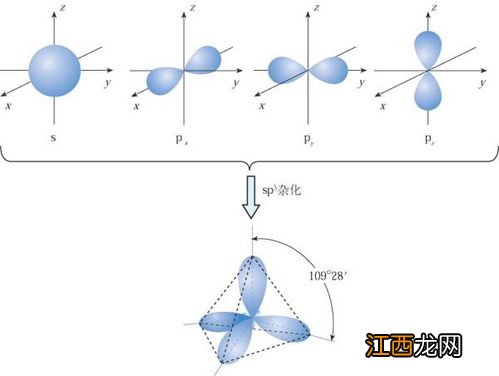
SP3杂化:由一个S原子轨道和三个P轨道杂化成四个SP3杂化轨道 。
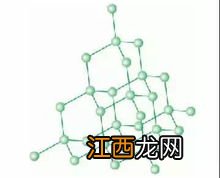
每个杂化轨道具有四分之一的S成份和四分之三的P成份 。轨道间夹角正好是109、5度,每个SP3杂化轨道分别指向正四面体的四个顶点 。采用SP3杂化成键的分子呈正四面体形状 。如金刚石中的碳原子,位于中间的碳原子与四个顶角上的碳原子形成共价键,配位数为四 。
以上就是关于sp3杂化轨道的内容 , 下面小编又整理了网友对关于sp3杂化轨道相关的问题解答,希望可以帮到你 。
文章插图
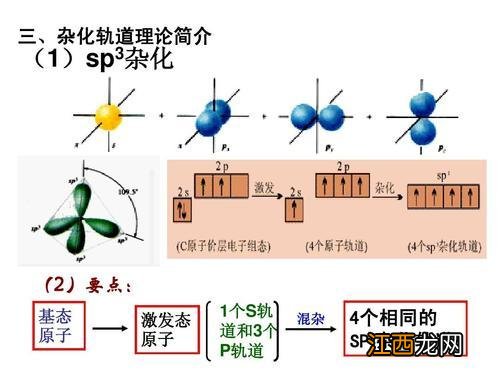
sp3杂化轨道是怎样形成的?sp3杂化一般发生在分子形成过程中,杂化发生后,原子最外层s轨道中的一个电子被激发至p轨道,使将要发生杂化的原子进入激发态,该层的s轨道与三个p轨道发生杂化, 。
水分子中氧原子的杂化轨道为什么是sp3?杂化轨道理论中有一点:σ键和孤对电子必须占有杂化轨道 。水分子中有两对σ键成键电子和两对孤对电子,所以需要四条杂化轨道,sp2只有三条轨道,所以不行,sp3才 。
硫酸根离子的杂化轨道为什么是sp3?硫酸根,也可称为硫酸根离子,是一种无机离子,化学式为SO42- 。SO42-离子中,S原子采用sp3杂化,离子呈正四面体结构,硫原子位于正四面体体心,4个氧原子位于正 。
甲烷CH4的杂化轨道为什么是SP3?其实是有电子跃迁的,因为2s轨域和2p轨域之间的能量缺口很小,因此碳只需投入很少的能量便可将2s轨域上的一个电子跃迁到空2p轨域上,这样做的好处是,碳可以形成4 。
sp3杂化是什么意思?简单说,比如CH4 C的最外层电子排布为2s22p2 s亚层有1个轨道被2个电子占满,p亚层有3个轨道,其中2个轨道各占有1个电子,余一个空轨道. s亚层成对的2个电子拆开, 。
s8的sp3杂化怎样理解?一、杂化理由很简单: 直线型:SP 平面型:SP2 立体型:SP3等杂化 。S8是立体结构,硫原子d亚层不参与杂化,所以是SP3杂化 。二、价键理论 。一、杂化理由很简单:。
甲烷分子中的sp3杂化轨道是由4个H原子的2s轨道和c原子的2p轨道混合起来形成的 。为什么不是c原子的1s轨道?【关于sp3杂化轨道】轨道和3个2p轨道杂化形成 。sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组 。甲烷分子(CH4)中的sp3杂化轨道是由中心碳原子的能量相 。
为什么次氯酸sp3杂化?次氯酸的中心原子是CI原子,分子中氯原子是sp3杂化 。次氯酸的结构式是H一O一CI 。从价电子对理论分析,氯原子最外层有7个电子,其中与氧原子形成一个西格玛键,这 。
什么叫做SP3杂化?同一原子内由1个ns轨道和3个np轨道参与的杂化称为sp3杂化 。sp3杂化一般发生在分子形成过程中 。杂化发生后,原子最外层s轨道中的一个电子被激发至p轨道,使将要 。
文章插图
相关经验推荐
- 关于菜品摄影技巧
- 关于霸王花植物的资料
- 关于d小调问题
- 关于吃到美食心情的词语
- 关于初中升高中的学籍问题
- 关于保税区出口退税
- 关于安全的座右铭
- 关于本末倒置的名人名言
- 关于win7睡眠文件删除
- 关于变化的成语















