印度邦德尔坎德医学院等团队的研人员对印度2021年4月至2021年7月期间,也就是印度第二波COVID-19大规模暴发期间的病例进行了回顾性研究发现 , 有37例儿童仅有肝炎症状,其他炎症标志物未升高,支持治疗后恢复顺利,他们当时将这些病例定义为“儿童新冠相关肝炎”( CAH-C) , 而非另一种“儿童多系统炎症综合征”(MIS-C) 。记录显示 , 这些儿童均感染过SARS-CoV-2,仅3例检测到腺病毒阳性 。
来自中科院上海营养与健康研究所、广东实验室的两位研究人员指出,T细胞反应对消除病毒感染至关重要,对SARS-CoV-2也是如此 。病毒的清除最终产生了一个持续的T细胞库,它将不同的T细胞受体(TCR)组合处理为与病毒相关的抗原,从而为同一病毒的继发感染留下保护 。通常,这些T细胞受到控制,不会攻击人体组织 。但在某些情况下,病毒感染导致免疫紊乱,引起自身免疫性疾病,这与外周耐受性紊乱有关 。
基于这些知识 , 他们假设病毒突变可能产生新的抗原,模仿自身多肽,并在适当的炎症微环境中引发自身免疫反应,从而与不明原因肝炎的出现有关 。
文章插图
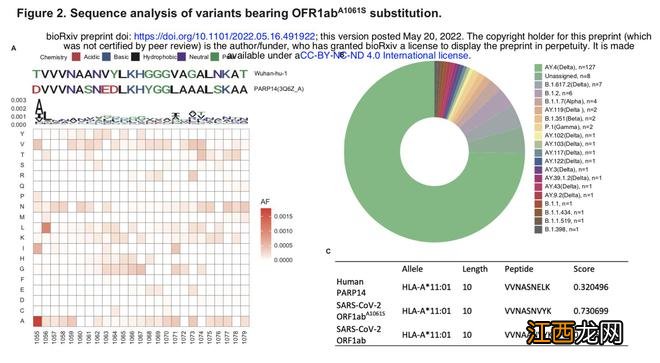
SARS-CoV-2 ORF1ab^A1061S替换增加了与人类PARP14的序列一致性,以及该突变体的流行病学特征 。
为验证该假设,研究人员将SARS-CoV-2 原始毒株与人类参考基因组进行全基因组比对 。在所有比对的SARS-CoV-2蛋白中,只发现ORF1ab^1056-1173与人类PARP14中的一个序列PARP14^53-176(序列ID: 3Q6Z_A)具有较高的同源性 。最相似的肽位于一个含有7个氨基酸残基的基序中,在这段基序中,只发现了一个氨基酸差异ORF1ab^1061与PARP14^58 。此外 , PAPR14^62-75也与ORF1ab^1065-1078具有较高的一致性 。
他们指出,自SARS-CoV-2第一个序列发布以来,病毒已经历了多次突变 。SARS-CoV-2基因组中突变的积累将影响功能特性 , 并可能改变传染性、疾病严重程度或与宿主免疫的相互作用 。因此有理由推测,可能存在一些ORF1ab^1056-1062发生突变的SARS-CoV-2变异体,增加了和人类PARP14^53-59 (3Q6Z_A)的同源性 。
为了验证这一假设,他们继续下载了保存在GISAID (https://www.gisaid.org/)上的SARS-CoV-2变异体蛋白 。对ORF1a蛋白的1055-1077段氨基酸序列进行了序列分析 。在所有SARS-CoV-2蛋白序列中(截至2022年5月10日,共有10541935条),有170条在ORF1ab的1061位点存在丙氨酸(A)到丝氨酸(S)的替换 。值得注意的是,这一改变使上述氨基酸序列与人类PARP14^53-59 (3Q6Z_A)相同 。
进一步分析显示 , SARS-CoV-2 ORF1ab^VVVNASN变异已在5大洲的15个国家被记录,全球总体频率为0.00161% 。值得注意的是,与首次报道的不明原研究者们提出 , 这与首次报道不明原因肝炎病例一致,即SARS-CoV-2 ORF1ab^VVVNASN变异主要出现在英国(135)和美国(18) 。
文章插图
基于OFR1ab^A1061S替换的变异体序列分析 。
【儿童不明原因肝炎新研究指向新冠病毒一突变:引发自身免疫性肝炎】研究人员继续使用一种HLA结合预测工具(http://tools.iedb.org/mhcii/),通过默认的MHC-I分子阵列来预测肽结合能力,从而评估来自人类PARP14和SARS-CoV2 ORF1ab的高相似肽对HLA分子的结合潜力和使用重叠 。
HLA也被称为人类白细胞抗原,是编码人主要组织相容性复合体(MHC)的基因复合体 。MHC在不同细胞表面表达 , 对抗原提呈和免疫信号传递起关键作用,不仅控制着同种移植排斥反应,更重要的是与机体免疫应答、免疫调节及某些病理状态的产生均密切相关 。
相关经验推荐
- 在韩橄榄球赛事“放错”中国国歌,专业人士认为背后原因蹊跷
- 鱼塘蓝藻爆发的原因是什么 鱼塘蓝藻爆发的原因是什么引起的
- 新买的儿童电话手表怎么激活 儿童电话手表怎么激活
- 富贵竹怎么水养才旺盛原因 富贵竹怎么水养才旺盛原因分析
- 《女儿们的恋爱4》周扬青罗昊为什么分手?分手的原因是什么?
- 《脱口秀大会》王勉为什么退赛,王勉突然宣布退赛的原因
- 苹果手机照相屏幕抖动是什么原因
- 大蒜空心是什么原因 大蒜空心是什么原因造成的
- 茼蒿叶子苦 茼蒿苦是什么原因
- 豇豆死苗原因 豇豆枯萎病














