文章插图
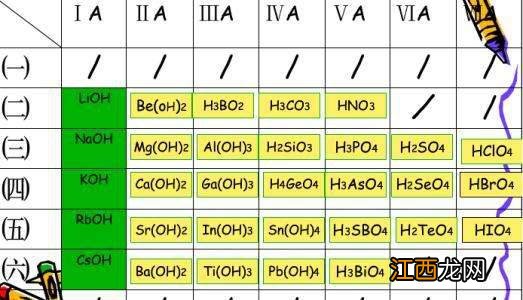
【br最高价氧化物对应的水化物 简介最高价氧化物对应水化物的几种情况】1、Br最外层7个电子,最高价+7,对应氧化物Br2O7 Br2O7对应水化物(其实就是酸)HBrO4关键:对应的时候 ,化合价是一样的.Na最外层一个电子,最高价+1 对应氧化物Na2O Na2O对应的水化物(其实就是碱)NaOH
2、最高价氧化物对应的水化物有以下几种情况:如果该元素是非金属,那么它的最高价氧化物对应的水化物就是含氧酸,如磷酸,硫酸 。如果是金属元素,那么对应的最高价氧化物的水化物就是碱,如氢氧化钠,氢氧化铜.大部分碱都是不可溶于水的,除氢氧化钠、氢氧化钾、氢氧化钡、氢氧化钙(微溶),不溶于水的碱都是弱碱 。在这些化合物中,该元素的价态均为最高价 。对于非金属元素来说指的是它对应的最高价含氧酸,如硫元素的最高价氧化物的水化物是指H2SO4 , 氮的最高价含氧酸指的是硝酸 。对于金属元素指的是它最终生成的碱,如钠的最高价氧化物的水化物是指氢氧化钠 。
以上就是br最高价氧化物对应的水化物 简介最高价氧化物对应水化物的几种情况的内容,下面小编又整理了网友对br最高价氧化物对应的水化物 简介最高价氧化物对应水化物的几种情况相关的问题解答,希望可以帮到你 。
文章插图
br和na的最高价氧化物对应的水化物碱性最强的是?如何比较?元素最高价氧化物对应的水化物碱性最强---金属活动性最强 。元素最高价氧化物对应的水化物酸性最强---非金属活动性最强 。1-20号元素中,金属性最强---K;非金 。
Cl和Br哪一个氧化性大?鉴别元素非金属性(即氧化性)的强弱有四种方法: 1.通过非金属单质间的置换来判断.如:把Cl2通入NaBr溶液中可置换出Br2,则氯的非金属性比溴强. 2.根据其最高价氧 。
溴的氧化物有哪些?及其物态?溴的氧化物有Br2O、BrO2、BrO3、Br3O8等,对热不稳定 。至于状态的话相同元素构成的二元化合物应该是主要考虑相对分子质量,相对分子质量增大,就由气→液→固吧 。
非金属性顺序表口诀?3、气态氢化物的越稳定,非金属性越强 。如稳定性:HF>H2O>HCl>NH3>HBr>HI>H2S>PH3,所以非金属性:F>O>Cl>N>Br>I>S>P 。4、最高价氧化物对应的 。如HClO、 HClO 。
为什么元素的非金属性碳大于氢?由单质的氧化性判断,一般情况下,氧化性越强,对应非金属性越强 。2、由单质和酸或者和水的反应程度来看,反应越剧烈,非金属性越强 。(比如F2 Cl2 Br2 和H2O的 。
为什么非金属元素的电子能力越强其得电子后放出的?元素的非金属性越强,原子得电子能力通常就越强,氧化性普通也越强 。元素的非金属性通常表示获得电子的倾向 。同时还包括很多方面: 1、元素的原子得电子的能力 。
为什么无氧酸中碘化氢酸性最强?碘化氢是卤素气态氢化物中最不稳定、还原性最强、水溶液酸性最强的 。它用于制备碘化物和用作有机反应中的还原剂;很稀的氢碘酸用于医药 。化学式HI 。有刺激性臭 。
氧化性是非金属性还是金属性?非金属性是氧化性 。元素的非金属性包括很多方面:元素的原子得电子的能力,氢化物的稳定性,最高价氧化物水化物酸性强弱等 。它包含了原子得电子的能力(氧化性), 。
元素周期表还原性比较?不要背啊,记住氧化还原反应之后的产物, 是“强氧化剂制弱氧化剂”,“强还原剂制弱还原剂”,如 铝可以置换铁,铁可以置换铜 举例! 氧化性:f2>cl2>br2>fe3+>i 。
相关经验推荐
- 碳的最高价氧化物对应的水化物 碳的最高价氧化物对应的水化物是什么
- 晚秋对应的情侣网名 秋日甜长情侣另一半网名
- 铝的最高价氧化物对应的水化物 铝的最高价氧化物对应的水化物是什么
- p的最高价氧化物 p的最高价氧化物是什么
- 哪些金属氧化物是共价化合物 是共价化合物的金属氧化物简述
- 清平乐赵徽柔是谁生的 赵徽柔的历史原型对应的是哪位公主
- 夏季怎么护理皮肤 针对不同皮肤问题采取对应措施!
- 焊接弯头的标准尺寸规格是什么 焊接弯头的对应标准尺寸
- 古代时辰与现代时间的对应 这些小知识你都知道吗
- 久别的草原原唱 对应的歌词内容有哪些